تعدّ البروتينات بمنزلة الوحدات الأساسية للحياة. فهي عبارة عن سلاسل طويلة من الأحماض الأمينية التي تتجمع بشكل ذاتي في وحدات جزيئية بتعقيد استثنائي. تشتمل هذه الوحدات على أجزاء مسؤولة عن الحوسبة تسمى الريبوسومات، وعلى تراكيب بنيوية تسمى الأنيبيبات الدقيقة، وعلى أجزاء شبيهة بالساق مخصصة للحركة تسمى الكينيسينات، بالإضافة إلى الكثير من الأجزاء الأخرى.
وتعدّ عملية التجميع الذاتي هي إحدى أعاجيب العلوم الحديثة، كما لو أن سلسلة من قطع الليغو تجمّعت فجأة على شكل روبوت. لا أحد يعرف تماماً كيفية حدوث ذلك، ولكن العلماء يدركون أن شكل البنية الناتجة يحدد وظيفة البروتين وكيفية تفاعله مع البروتينات الأخرى.
لذلك يعد قياس شكل البروتينات من المهام الحاسمة. والطريقة الأكثر شيوعاً لذلك هي تشكيل بلورات من البروتينات ثم استخدام دراسة البلورات بالأشعة السينية لتحديد بنية البروتين.
إلا أن هذا الأمر يعد مشكلة لأن معظم البروتينات لا تشكّل بلورات. وحتى عندما تقوم بذلك، فإن جزيئات البروتين قد لا تأخذ جميعها نفس الشكل مع تشكلها، مما يؤدي إلى عدم الدقة.
وهناك طريقة أخرى تسمى الرنين المغناطيسي النووي وتؤدي إلى إنشاء صور للبروتينات الموجودة على هيئة محلول، ولكنها تتطلب أن تتجمّع على هيئة حزم مكتظة. ومرة أخرى، لا يمكن سوى لعدد قليل من البروتينات القيام بذلك.
ومع ذلك، يمكن تصوير جزء ضئيل من البروتينات بكلتا التقنيتين، مما يعدّ أمراً مفيداً لأنه يسمح لعلماء البيولوجيا الجزيئية بمقارنة البنى الناجمة عن كل تقنية.
وقد اتضح أن البنى التي يتم التوصل إليها بكل تقنية تختلف بطرق كبيرة. ولكن ليس من الواضح بالضبط سببُ هذه الاختلافات وكيفية تفسيرها.
والآن، يتغير هذا الأمر -بشكل جزئي على الأقل- بفضل أبحاث جي مي وزملائها في جامعة ييل بمدينة نيوهافن. قام هذا الفريق بقياس الفرق في بنية البروتين الناجمة عن دراسة البلورات بالأشعة السينية وعن الرنين المغناطيسي النووي. وقد توصلوا إلى سبب ظهور الاختلاف وكيفية تصحيحه.
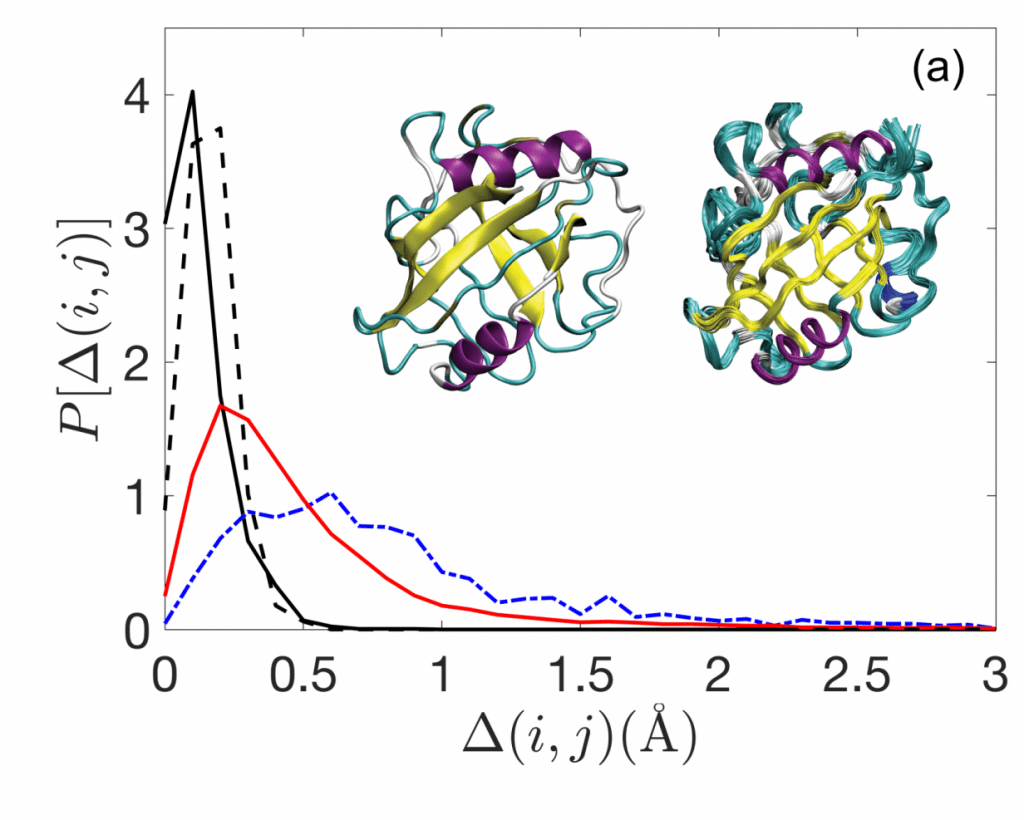
بدأ الفريق من خلال تجميع قاعدة بيانات للبروتينات تحتوي على بنى ناجمة عن كلتا التقنيتين بدقة عالية. وتبين أن تلك القائمة كانت صغيرة نسبياً، حيث احتوت على 16 بروتيناً ملائماً فقط.
كما أنشأ الباحثون قاعدة بيانات للبنى البروتينية الناجمة عن دراسة البلورات بالأشعة السينية والتي تحددها عدة مجموعات مختلفة بدرجات حرارة مختلفة، مما سمح للفريق بدراسة كيفية تأثير درجة الحرارة على البنى.
ثم ابتكروا نموذجاً رياضياً للطريقة التي تتجمع بها البروتينات مع بعضها لتشكيل بلورات صلبة أو حزم في محلول لدراستها بالرنين المغناطيسي النووي.
واتضح أن كثافة التجميع يمكنها أن تفسر بالضبط الفرق في البنى بكلا التقنيتين، حيث تمتلك الحزم في المحلول كثافة أعلى من البلورات. ويقول الباحثون: "نقوم بتحديد الأساس الفيزيائي لهذه الاختلافات من خلال تشكيل نوى البروتين على هيئة حزم مكتظة بالجزيئات التي لها شكل الأحماض الأمينية".
ويمكنهم أيضاً ضبط نموذجهم الرياضي من خلال تغيير الطاقة الحرارية المستخدمة لإنشاء الحزم. وفي الواقع، فإن حزم البروتين التي لا تتأثر بالحرارة لها نفس الكثافة التي تمتلكها البنى التي تحددها دراسة البلورات بالأشعة السينية.
وهذا يشير إلى أن درجة الحرارة تلعب دوراً مهماً في بنية الحزم البروتينية، لأن البنى التي يحددها الرنين المغناطيسي النووي تكون أكثر كثافة. وتقول مي وزملاؤها: "تشير هذه النتائج إلى أن الأنظمة الحرارية يمكن أن تتجمّع بشكل أكثر كثافة من الأنظمة غير الحرارية، مما يشير إلى وجود أساس فيزيائي للاختلافات البنوية بين بنى البروتين الناجمة عن الرنين المغناطيسي النووي ودراسة البلورات بالأشعة السينية".
ومع ذلك، فإن درجة الحرارة ليست هي كل شيء. إذ تُجبر البروتينات ذات البنى البلورية إلى اتخاذ شكل معين، وهذا يقلل من مقدار التشوّه الحراري الذي يمكن أن يتعرض له الجزيء.
لذا فإن النتائج التي توصلت إليها مي وزملاؤها تطرح سؤالًا مثيراً للاهتمام، وهو: إلى أي مدى تكون بنية البروتين ناجمة عن درجة الحرارة أو عن التجمّع البلوري؟
وللإجابة عن هذا السؤال، لا بدّ من الانتظار لحين إجراء المزيد من الأبحاث.
المصدر: arxiv.org/abs/1907.08233:
Analyses Of Protein Cores Reveal Fundamental Differences Between Solution And Crystal Structures