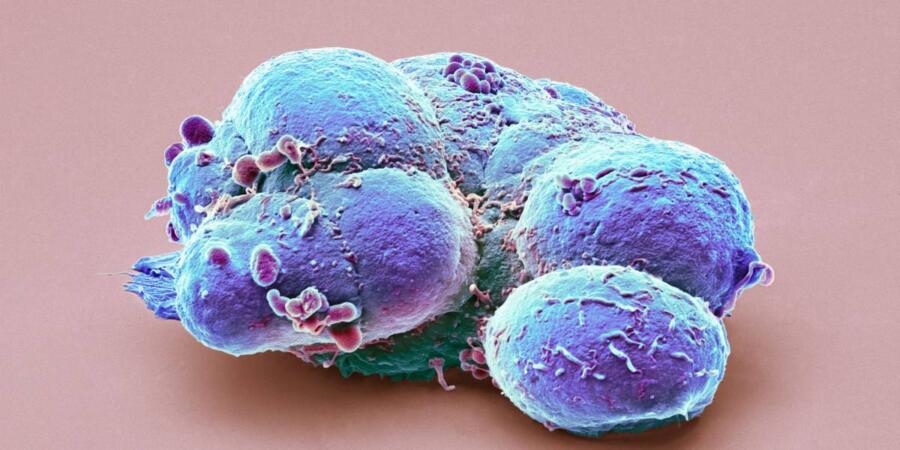
قبل 25 عاماً، عام 1998، عزل الباحثون في ولاية ويسكونسن الأميركية الخلايا الجذعية ذات القدرات الهائلة من الأجنّة البشرية. مثَّل ذلك إنجازاً مهماً غير مسبوق في مجال علم الأحياء، لأن هذه الخلايا تنمو لتشكّل جسم الإنسان بأكمله، ولديها القدرة على التحوّل إلى أي نوعٍ آخر من الخلايا، مثل خلايا القلب والخلايا العصبية وغيرها.
لخّص الخبراء في مجلة ناشيونال جيوغرافيك لاحقاً الإمكانات المذهلة لهذا الإنجاز قائلين: "الهدف هو بدء ثورة في مجال الطب تُمكننا من ترميم الأعضاء والأنسجة المريضة" بأجزاء بديلة حيّة. كان هذا الإنجاز بمثابة بداية حقبة جديدة، وكان حلاً منشوداً، وتحدّث الجميع عن إمكاناته المحتملة بغض النظر عن ماهيتها.
مع ذلك، اليوم، وبعد أكثر من عقدين من الزمن، لا توجد علاجات في السوق تعتمد على هذه الخلايا. ولا حتى واحد.
لمعرفة سبب ذلك، حضرتُ في يونيو/ حزيران 2023 الاجتماع السنوي للجمعية الدولية لأبحاث الخلايا الجذعية، وجلستُ في الصفوف الأولى في قاعة مع المئات من علماء الأحياء. عُرضت على شاشة ضخمة صورة مخيفة نوعاً ما باللونين الأبيض والأسود لخلايا التُقِطت باستخدام المجهر. كان بعضها مستديراً مع امتدادات تشبه الشعر، بينما كان البعض الآخر مقاطع عرضية مستطيلة مليئة بمادة غامضة تشبه الرمال. انبثقت الموسيقي التيمية من المسرح، وهي أغنية باسم "أريد دواءً جديداً" لفرقة هيوي لويس آند ذا نيوز (Huey Lewis and the News).
أتيحت لي خلال الاجتماع الفرصة لمقابلة علماء قدماء، يمثّل بعضهم "مصادر قديمة" للمعلومات بالمعنى الحرفي للكلمة؛ إذ إنهم تحوّلوا بسبب ربع قرن من العمل الشاق في هذا المجال إلى عمداء أو مستشارين هرمين. سألتُ قائلاً: "هل العمل لأكثر من 25 سنة في هذا المجال هو إطار زمني عادي أمْ أن هناك خللاً ما في هذه التكنولوجيا التي تتفاخرون بها؟" بالنسبة لمعظم الأشخاص الذين تحدثت معهم، فإن التأخير المأساوي في مجال الخلايا الجذعية البحثي ليس مفاجئاً. هذا بالفعل هو الوقت الذي يمكن أن يستغرقه تطوير تكنولوجيا حيوية جديدة حقاً. أجري أول اختبار للعلاجات الوراثية على البشر في عام 1980، ولكن لم يحصل أول دواء وراثي على موافقة البيع حتى عام 2012 في أوروبا. وفقاً لهذا المقياس، يبدو أن البحث في الخلايا الجذعية يسير في الطريق الصحيح.
اقرأ أيضاً: هل يمكن تشكيل الأجنة الحية من الخلايا الجذعية في المستقبل القريب؟
استخراج الخلايا الجذعية أمر سهل لكنّ الصعب هو تحفيزها
أقرّ آخرون بأنه من الواضح أن إدخال الخلايا الجذعية في مجال الطب صعب على نحو مدهش. يتمثل التحدي الرئيسي في أن الخلايا ليست مثل الأسبرين أو الأدوية الأخرى التي يمكن صنعها بكميات كبيرة؛ إذ إنها كائنات حية يمكن أن تتغير أو تموت أو حتى تخرج عن السيطرة، مسببة المخاطر مثل السرطان. بالنتيجة، اتضح أن استخراج الخلايا الجذعية الجنينية كان الخطوة الأسهل، بينما تحفيزها على توليد الخلايا المتخصصة، أي تلك التي تؤدي وظائف محددة ضرورية لعلاج الأمراض، هو الخطوة البالغة الصعوبة.
قال الأستاذ في جامعة ستانفورد، ماثيو بورتيوس، الذي طرحتُ عليه الكثير من الأسئلة بينما كان يقف على منصة في الاجتماع: "يستغرق تطوير الأفكار وقتاً طويلاً، لكن فكرة استخدام الخلايا الجذعية لا تزال مناسبة".
هناك مؤشرات تبيّن أن مجال تطوير العلاجات المعتمدة على الخلايا الجذعية سيشهد نقلة نوعية كبيرة أخيراً. وفقاً لمسح أجري عام 2023، أجري ما يقرب من 70 اختباراً جديداً على المتطوعين في السنوات الأربع الماضية، وهو معدل يبلغ 3 أضعاف من المعدل السابق. تجري شركة فيرتيكس فارماسيوتيكلز أحدث هذه الدراسات البشرية المبكّرة، وقال المسؤولون فيها في يونيو/ حزيران 2023 إن العلاج المُختبر كان فعالاً بما يكفيليغني مريضين مصابين بالسكري أخذا حقنات من خلايا البنكرياس المصنوعة في المختبر عن تناول الإنسولين. تبيّن النتائج المبكرة لاختبارات الخلايا المصنّعة المخصصة لعلاج العمى والصرع أن الخلايا المزروعة فعّالة.
قال الأستاذ في جامعة هارفارد والرئيس المنتهية ولايته للجمعية الدولية لأبحاث الخلايا الجذعية، هايفان لِن: "هناك الكثير من الإنجازات على وشك الحدوث. لا أعتقد أن تطوير العلاجات تأخّر، وذلك لأن الخلايا الجذعية هي الأعقد من بين الخلايا حقاً".
اقرأ أيضاً: مقابلة مع البروفيسور جوزيبي موتشي: هل يمكن للخلايا الجذعية أن تعيد إليك شبابك؟
الصفحة البيضاء
كتبتُ مقالات عن الخلايا الجذعية الجنينية منذ البداية، وحتى قبل بدء البحث في هذا المجال بقليل. كانت مجلة إم آي تي تكنولوجي ريفيو أول من تحدّث عن موضوع السعي لعزل الخلايا الجذعية، وهو مجهود نُفّذ على ضوء التهديد الوشيك المتمثل في معارضة النشطاء المناهضين للإجهاض. مهّد غلاف عدد شهري يوليو/ تموز وأغسطس/ آب لعام 1998 الذي حمل اسم "محرّمات التكنولوجيا الحيوية" (Biotech Taboo) للموضوع باحتوائه على صورة لطبق بتري يلمع في الظلام.
كتبتُ في هذا العدد: "إذا مُنحت جوائز لأكثر المساعي العلمية سريَّةً وإثارةً للجدل، من المرجح أن يفوز مجال البحث عن الخلايا الجذعية الجنينية فيها جميعها". قلنا للقراء عندها إن هذا البحث هو بحث عن خلايا "الصفحة البيضاء"، أي تلك القادرة على توليد أي نوعٍ آخر من الخلايا في جسم الإنسان. كانت الخلايا الجذعية الجنينية تمثّل "مصنعاً محتملاً في طبق" يمكن أن يمنح العلماء "القدرة على إنماء الأنسجة البشرية حسب الرغبة" لأول مرة. وكان هذا الموضوع من المحرمات لأن هذه الخلايا كانت موجودة فقط في الأجنة البشرية في المراحل المبكّرة من النمو، وكان من الضروري قتل هذه الأجنة بهدف عزل الخلايا في عيادات التلقيح الاصطناعي.

بعد أشهر قليلة من نشر العدد السابق الذكر، انتهى هذا السباق العلمي؛ إذ أفاد الباحث في جامعة ويسكونسن، جيمس تومسون، في نوفمبر/ تشرين الثاني 1998 بأنه استخرج الخلايا الجذعية من 5 أجنة وأنه يحافظ على هذه الخلايا حية وقيد التكاثر في مختبره.
احتوت الورقة البحثية التي ألّفها تومسون، وهي تتألف من 3 صفحات مقتضبة نُشرت في مجلة ساينس (Science)، على رسم تخطيطي يبيّن كيف يمكن أن تتحول الخلايا الجذعية إلى تكنولوجيا طبية باعتقاده. تنبأ تومسون أنه عند شح الأعضاء أو الخلايا المستخلصة من الجثامين، فإن الخلايا الجذعية "ستوفّر مصدراً قد يكون غير محدود للخلايا التي ستستخدم في مجالي تطوير الأدوية وطب زرع الأعضاء"، وخصوصاً لأنها تفسح المجال "للإنتاج النمطي" لأنواع الخلايا المتخصصة مثل خلايا القلب النابضة أو خلايا بيتا التي تتحسس الغلوكوز. أشار أيضاً إلى أن بعض الأمراض، وتحديداً داء السكري من النوع الأول ومرض باركنسون، ينجم عن "موت نوع واحد أو عدة أنواع من الخلايا أو خلل في وظيفتها". إذا أمكن استبدال تلك الخلايا المحددة، سيؤدي ذلك إلى "علاج هذه الأمراض تماماً". هذه الرؤية، التي تنص على أن أصل الخلايا جميعها يمكن استخدامه لاستبدال أي نسيج أو حتى لإعادة إنماء الأعضاء، هي التي حفّزت جيلاً كاملاً من الباحثين على العمل في هذا المجال.
تقول الأستاذة الفخرية في معهد سكريبس للأبحاث والمؤسسة الشريكة لشركة آسبن نيورو ساينس التي تسعى لعلاج مرض باركنسون بزرع الخلايا التي تركّب الدوبامين، جين لورينغ: "هذه الخلايا هي أقرب ما أعرفه للسحر؛ إذ إنها تستمر في الانقسام وتولّد أي نوع آخر من الخلايا. إذا كنت عالم أحياء خلوية، فالخلايا الجذعية هي الحل المنشود. لكن المشكلة تكمن في تحويل هذه الخلايا إلى النوع المحدد والمرغوب من الخلايا". بالإضافة إلى ذلك، إذا وُفّرت الظروف الملائمة لتكاثر الخلايا الجذعية في المختبر، يمكن أن تتراكم الطفرات فيها، ما يزيد مخاطر السرطان المحتملة. تقول لورينغ: "هنا يصبح هذا السحر خطيراً".
اقرأ أيضاً:من أبوظبي: تجارب سريرية ناجحة لعلاج كوفيد-19 باستخدام الخلايا الجذعية
الاختبار السياسي
واجه مجال الخلايا الجذعية بعد ذلك اختباراً مصيرياً، لكنه كان سياسياً وليس علمياً. قُوبل هذا الاكتشاف برد فعل غاضب من المنظّمات الدينية في الولايات المتحدة لأن الخلايا الجذعية استُخرجت من أجنة أطفال الأنابيب الصغيرة ولكن الحية، وهي عملية تؤدي إلى قتل هذه الأجنّة.
انتُخب جورج دبليو بوش رئيساً للولايات المتحدة بعد عامين من نشر ورقة تومسون. وبهذا، أصبح للمحافظين المسيحيين مدخل إلى البيت الأبيض، وأرادوا حظر التمويل الفيدرالي عن مجال البحث في الخلايا الجذعية. استجاب العلماء بحملة ضغط ساحقة بمساعدة مناصري المرضى. اجتمع هؤلاء بهدف دعم تطوير العلاجات، واحتوى بعض من اللافتات التي رفعوها على عبارات مثل "أنا أحب الخلايا الجذعية".
جعلت الفكرة التي تنصُّ على أن الخلايا الجذعية هي علاجات الإنجازات غير المسبوقة في هذا المجال البحثي تبدو أقرب مما عليه في الواقع. شارك رئيس تحرير مجلة ستيم سيل ريبورتس الأكاديمية (Stem Cell Reports)، مارتن بيرا، في هذه الحملة، وكتب في افتتاحية نُشرت في ذلك العام أن العلاجات ستُطور "قريباً"، ولكن فقط إذا موّلت الحكومة والجمعيات الأبحاث العلمية. قال لي بيرا عندما رأيته في اجتماع الجمعية الدولية لأبحاث الخلايا الجذعية: "كنا نفكّر بطريقة غير واقعية في ذلك الوقت. وذلك لأن جل ما توصّل إليه العلماء عندها هو عزل الخلايا الجذعية غير المتمايزة".
حلّل أستاذ قانون الصحة في جامعة ألبرتا، تيموثي كولفيلد، المقالات الإخبارية لاحقاً واكتشف أن العلماء قدّموا باستمرار "تصريحات واثقة" تتضمن "جداول زمنية غير واقعية" حول توقيت طرح العلاجات. يقول كولفيلد: "لا ألوم الباحثين على ذلك؛ إذ إنهم اضطروا للحديث علناً عن الموضوع، وتبدو فترة عقد من الزمن قصيرة على الرغم من أنها ليست كذلك. يجب عليهم أن يعرضوا الموضوع بطريقة تبين أنه مثير للحماس وثوري. وإن لم يفعلوا ذلك، سيفقدوا التمويل لصالح مجال آخر".
اقرأ أيضاً: ما هي تقنية إعادة البرمجة الوراثية وهل يمكن استخدامها لإطالة عمر البشر؟
لكن الجمهور وثق بهذه الأطر الزمنية، بالإضافة إلى الفكرة التي تنصُّ على أن نقص التمويل هو الذي يعوق تطوير العلاجات فقط. لذلك، بعد أن فرضت الولايات المتحدة بعض القيود على أبحاث الخلايا الجذعية؛ إذ إنها سمحت بتمويل الأبحاث التي تستخدم الخلايا الجذعية من مصادر محددة قليلة فقط، سددت مجموعات المرضى ضربة مضادة. أسّست مبادرة الاقتراع باسم المقترح 71 التي أُطلقت عام 2004 معهد كاليفورنيا للطب التجديدي في ولاية كاليفورنيا. أصبح البحث في مجال الخلايا الجذعية "حقاً دستورياً" في الولاية بموجب هذه المبادرة، التي خصصت 3 مليارات دولار من أموال الضرائب لهذا المجال البحثي لمدة 10 سنوات. توقّع أعضاء جماعات الضغط أنه بحلول ذلك الوقت، ستُسترد هذه الأموال مضاعفةً نتيجة لوفرة الوظائف والعلاجات. سيوفّر علاج داء السكري من النوع الأول فقط (ما كان سيحدث "في العام السادس" وفقاً لأحد التوقعات) 122 مليار دولار من تكاليف الإنسولين والتكاليف الأخرى. نصّ أحد الإعلانات التلفزيونية على أن الخلايا الجذعية ستشفي "مليون شخص من مرض باركنسون".
لم يُطرح أي من هذه العلاجات في السوق بعد. ومات العديد من مناصري المرضى الذين نشطوا في تلك السنوات، الذين أمل بعضهم أن تنقذهم الخلايا الجذعية، ومنهم جينيفر إستيس وديفيد أميس والممثل كريستوفر ريف وجوردان كلاين. جوردان كلاين هو ابن رجل الأعمال العقاري من ولاية كاليفورنيا، بوب كلاين، الذي أطلق المقترح 71. وفقاً لمجلة لونغ بيتش بيزنس جورنال (Long Beach Business Journal)، حمّل بوب كلاين مسؤولية وفاة ابنه للتأخيرات السياسية بعد وفاة هذا الأخير بسبب مضاعفات داء السكري من النوع الأول عام 2016 عن عمر يناهز 26 عاماً. قال بوب للمجلة: "مات ابني الأصغر. ولو لم تؤخر العاصمة هذه الأبحاث، لكان حياً الآن".
"كان يُنظر لموضوع الخلايا الجذعية وكأنه صراع بين الأفكار الطوباوية والمريرة في أوائل العقد الأول من القرن الواحد والعشرين".
تيموثي كولفيلد
أصبح الاعتقاد بأهمية العلاجات المعتمدة على الخلايا الجذعية مترسخاً. بالنسبة لأشخاص مثل كلاين، فإن التدخّلات السياسية هي التي أخرّت تطوير هذه العلاجات. يقول كولفيلد: "كان يُنظر لموضوع الخلايا الجذعية وكأنه صراع بين الأفكار الطوباوية والمريرة في أوائل العقد الأول من القرن الواحد والعشرين.
كان هناك أشخاص يقولون إن هذه الأبحاث غير أخلاقية أو يجب عدم السماح بإجرائها. وتعيّن على المجتمع البحثي، الذي كنت أنتمي إليه، أن يقاوم ويصرّح بأن هذا المجال مثير وأن الباحثين سينقذون الأرواح. ولا يزال الطرفان يتحدثان بالطريقة نفسها اليوم". ولكن ما الأدلة الأوضح على ذلك؟ على سبيل المثال، العيادات الطبية غير الموثوقة التي بدأت بالاستفادة من الضجيج الإعلامي وأعلنت عن علاجات الخلايا الجذعية المخصصة للتوحّد والصداع النصفي والتصلب المتعدد، وهي ظاهرة يُطلق عليها كولفيلد اسم "الاستغلال العلمي". لسنوات عديدة، عرضَ أي بحث عن الخلايا الجذعية على موقع جوجل إعلانات من عيادات مشبوهة تقدّم علاجات لأي مرض تقريباً، باستخدام الخلايا التي استُخلصت من الدم أو الأنسجة الدهنية عادة.
اكتشفت مدى انتشار هذه الظاهرة في ربيع عام 2023 عندما كشفت امرأة مسنّة من معارفي أنها دفعت أكثر من 7 آلاف دولار نقداً مقابل الحصول على حقنة يُدّعى أنها تحتوي على الخلايا الجذعية المستخلصة من عظامها على أمل علاج ركبتها التي تتسبب بالآلام. بالطبع، على الأرجح أن الحقنة لم يكن لها أي تأثير. كان بإمكانها توفير هذا المبلغ لو قرأت كتيباً بعنوان "دليل علاجات الخلايا الجذعية" تصدره الجمعية الدولية لأبحاث الخلايا الجذعية. على الرغم من عنوانه الذي يجعله يبدو وكأنه مسرد لمنتَج ما، هذا الكتيب هو تحذير مطوّل حول عيادات الاحتيال، يوضّح أن أي علاج معتمد على الخلايا الجذعية يُعلن عنه حالياً مزيّف.
يعود ذلك في الواقع إلى أنه لا يمكن تسريع عملية تطوير العلاجات المعتمدة على الخلايا الجذعية أكثر من سرعة الأبحاث العلمية المعتادة. يقول الأستاذ في جامعة كاليفورنيا في سان فرانسيسكو، أرنولد كريغستاين: "عندما أدرك الجمهور الإمكانات المحتملة للخلايا الجذعية، ظهرت فكرة تنصُّ على أن هذه الخلايا تمثّل علاجاً سحرياً بحد ذاتها، على الرغم من أن هذا أمر مثير للسخرية. تتمثل الإمكانات المحتملة الحقيقية للخلايا الجذعية في أنها قادرة على توليد الخلايا الأخرى حسب الحاجة، وليس في أنها علاج سحري. وهذه العملية ليست بسيطة أبداً؛ إذ إنها شاقّة وبطيئة. وهذا هو العلم في الواقع، نشاط مجهد ويستغرق الكثير من الوقت".
اقرأ أيضاً: كيف يحاول العلماء تجديد شبابك؟
إنجازات مؤخَّرة
لا تؤثّر السياسة اليوم في مجال الخلايا الجذعية البحثي كما فعلت من قبل. ويعود ذلك جزئياً إلى أن العلماء اكتشفوا بحلول عام 2006 كيفية تحويل أي خليّة، مثل الخلايا الجلدية، إلى خلايا تشبه الخلايا الجذعية الجنينية. تتطابق هذه الخلايا الجذعية "المستحثة" إلى حد كبير مع تلك المستخلصة من الأجنة، ولكنها لا تُثير أي جدل أخلاقي. ولكن اتضح أن تشكيل الخلايا الناضجة والمتخصصة (مثل تلك التي يمكن أن تُستخدم في عمليات زرع الأعضاء) من الخلايا الجذعية أصعب مما كان متوقعاً، بغض النظر عن نوع الخلايا الجذعية الذي يختار الباحثون استخدامه.
تحمل الاستراتيجية التي يتّبعها العلماء لتوليد أنواع الخلايا التي يريدونها من الخلايا الجذعية اسم "التمايز الموجَّه". يمكنك التفكير في هذه الاستراتيجية على أنها نهج للطبخ؛ إذ إنها تنصُّ مثلاً على إضافة عامل النمو سين في اليوم الثاني، والعامل عين في اليوم الثاني عشر، وهكذا. يعرّض الباحثون وفق هذه الاستراتيجية الخلايا الجذعية للعوامل الخارجية المؤثرة نفسها التي تتعرض لها في أثناء مراحل نمو الطفل.
على الرغم من أن هذه العملية قد تكون ناجحة، فإن التوصل إلى وصفة صحيحة صعب للغاية. على سبيل المثال، أمضى العالم دوغلاس ميلتون، الذي لديه طفلان مصابان بداء السكري من النوع الأول، ما يقرب من 15 عاماً حتى تمكّن من توليد خلايا بنكرياسية "وظيفيّة" قادرة على الاستجابة للغلوكوز وتركيب الإنسولين عند زرعها في الفئران. قال ميلتون، الذي طوّر علاج فيرتيكس (Vertex) الذي يخضع للاختبار حالياً، في أحد منشورات جامعة هارفارد عام 2021: "استغرق التوصل إلى حل لهذه المشكلة وقتاً أطول بكثير مما توقعت؛ إذ إنني أخبرت زوجتي أنه سيستغرق 5 سنوات فقط".
بالإضافة إلى ذلك، تستغرق عملية تحوّل الخلايا الجذعية إلى النوع المرغوب من الخلايا في الأطباق المخبريّة المدة نفسها تقريباً التي تستغرقها العملية في أثناء الحمل، كما أنها قد تستغرق 6 أو 7 أشهر فقط أحياناً.
جعل ذلك تجربة الأفكار الجديدة أصعب بكثير، وذلك لإن إجراء كل اختبار جديد سيؤدي إلى تأخير البحث أكثر. تقول العالمة الرئيسية في مستشفى ماس آي آند إير، وهو أحد مستشفيات جامعة هارفارد التعليمية، هانا لالو: "كنت أشعر بالتفاؤل في بداية العمل، ولكن إجراء كل تجربة قد يستغرق 200 يوم". شاركت لالو في مشروع هدف لاستخدام الغرسات لترميم سمع مجموعة من خنازير غينيا. أمل الباحثون في هذا المشروع أن تنمو الخلايا المزروعة لتشكّل الخلايا الشعرية السمعية، لكن ذلك لم يحدث. والآن، تختبر لالو تقنيات وراثية أسرع بدلاً من الغرسات الخلوية.
وتقول: "في مرحلة ما، لم أنظر لهذه الغرسات على أنها أداة علاجية. وما يريده المرضى في النهاية هو دواء". بالإضافة إلى ذلك، توليد الخلايا هو عملية مكلفة؛ إذ يكلّف غرام واحد من عامل النمو الذي يناسبها 750 ألف دولار. أضف إلى ذلك العوائق التنظيمية التي تواجه أي نهج غير مختبَر من قبل، وستدرك لماذا كانت أبحاث شركات التكنولوجيا الحيوية المتعلقة بالخلايا الجذعية متقطّعة. ألغت شركة جيرون، التي تحكّمت من قبل ببراءة اختراع تتعلق بالخلايا الجذعية الجنينية وأجرت أول اختبار بشري لعلاج طُوِّر من هذه الخلايا عام 2010، الدراسة التي أجرتها بعد عام واحد فقط. والآن، تعمل الشركة على تطوير أدوية السرطان وامتنعت حتى عن ذِكر الخلايا الجذعية الجنينية على موقعها الإلكتروني. تراجعت قيمة أسهم شركة أخرى للخلايا الجذعية تحمل اسم سانا منذ طرحها لعرضها العام الأولي لعام 2021، وسرّحت عام 2022 فريقاً عمل على تشكيل عضلة قلبية لعلاج أمراض القلب.
اقرأ أيضاً: شركة ناشئة تدعي أنها أحرزت تقدماً كبيراً في استعادة الشباب لكبار السن
تجارب المرحلة المبكرة
التكاليف المرتفعة والصعوبات التقنية ليست غريبة في عالم التكنولوجيا الحيوية، ولا تزال هناك مجموعة من المستثمرين والعلماء الذين يعتقدون أن علاجات الخلايا الجذعية تستحق المخاطرة. يقول باحثو الخلايا الجذعية اليوم إن العدد المتزايد من التجارب السريرية الجديدة (الذي يبلغ نحو 15 تجربة تُجرى سنوياً) يشير إلى أن هذا المجال قد يمر بنقطة تحوّل قريباً. لم يُثبت بعد أن عمليات زرع خلايا الشبكيّة المصنوعة في المختبر (وهي الطريقة التي تُختبر في أغلب الأحيان حتى الآن) تحسّن البصر، ولكن هناك أدلة من دراسة المجموعة الأولية من المرضى تبيّن أن الخلايا لها تأثير. وفقاً لدراسة استقصائية نُشرت عام 2022، تلقّى أكثر من 3 آلاف مريض الغرسات المصنوعة من الخلايا الجذعية المستحثّة أو الجنينية في نحو 90 دراسة، على الرغم من أن هذه الاختبارات جميعها لا تزال في المراحل الأولية.
يقول بيرا: التجارب التي تُجرى حالياً جميعها في المرحلة المبكرة. من غير المرجح أن تنتج هذه التجارب جميعها العلاجات، لكنها ستوفّر لنا معلومات حول كيفية تحسين هذه العلاجات".
اقرأ أيضاً: لأول مرة: ولادة أطفال حملتهم أمهاتهم بمساعدة روبوت
أحد الأسئلة التي لم نجد الإجابة عنها بعد، والتي لا يمكن الإجابة عنها إلّا بإجراء التجارب على البشر، هو ما عمر هذه الخلايا داخل الجسم. عندما تضاف الخلايا العصبية التي تُركّب الدوبامين إلى أدمغة المرضى المصابين بمرض باركنسون، وهي طريقة جُرّبت عدة مرات، تموت أغلبية هذه الخلايا العصبية في النهاية. عاد الباحثون إلى الأساسيات في محاولة لتفسير موت هذه الخلايا ولتعديل النهج الذي يتبعونه. ربما ما يجب عليهم فعله هو زيادة الجرعة فقط، على الرغم من المخاطر المحتملة؛ إذ إن عواقب زيادة نسب الدوبامين تكاد تكون بسوء انخفاضها، كما أنها قد تتسبب أيضاً بالحركات اللاإرادية. تبدو الدراسة التي أجرتها شركة فيرتيكس حول مرض السكري، التي من المتوقع أن تضم 40 شخصاً، واعدة أكثر، ولكن ليس من الواضح أيضاً كم ستعيش الخلايا المزروعة. يعني ذلك أن العلاجات المكلفة للغاية قد لا تكون دائمة، علماً أن بعض التقديرات يشير إلى أن الغرسات الخلوية لعلاج السكري تكلّف 500 ألف دولار على الأقل.
مع ذلك، تأمل لورينغ أن يوفّر أحد هذه الاختبارات قريباً أدلة مذهلة وقاطعة على أن العلاجات المصنوعة من الخلايا الجذعية الجنينية يمكن أن تعالج الأمراض بالفعل؛ إذ تقول: "قد يمثّل أحد هذه الاختبارات نقطة تحوّل. وأعتقد أننا بحاجة إلى هذا التحول حالياً".
اقرأ أيضاً: المهتمون بإطالة العمر يسعون إلى تأسيس دولة خاصة بهم: تعرف إلى التفاصيل
علاج الصرع
خلال الأيام الثلاثة التي قضيتها في تجمّع الباحثين في مجال الخلايا الجذعية، برزت إحدى الدراسات بالنسبة لي على أنها تمثّل الإنجاز غير المسبوق المهم الذي يحتاج إليه هذا المجال. هذه الدراسة هي تجربة جديدة تجريها شركة للتكنولوجيا الحيوية مقرها مدينة سان فرانسيسكو تحمل اسم نيورونا ثيرابيوتكس، وزرع الباحثون ضمنها قبل عام "الخلايا العصبية البينيّة المثبِّطة" المصنوعة في المختبر في مناطق عميقة من أدمغة شخصين مصابين بصرع مستعصٍ لم يستجب للأدوية العادية. يأمل الباحثون في أن الخلايا المضافة ستشكّل آلاف الوصلات وتقلل نشاط شبكات الدماغ المعطَّلة التي تتسبب بالنوبات.
أعلنت هذه الشركة خلال الاجتماع أن المريضين شهدا انخفاضاً بنسبة تتجاوز 90% في معدل النوبات. تقابل هذه النسبة في حالة رجل يبلغ من العمر 26 عاماً انخفاضاً من 32 نوبة منهكة في الشهر. إذا تبيّن أن البيانات قابلة للتكرار، قد يعني ذلك أن عملية زرع الخلايا فعّالة بقدر أكثر علاجات مرض الصرع المتاحة اليوم شدّة، وهو الاستئصال الجراحي لجزء من الفص الصدغي. مع ذلك، لن تكون لهذه الغرسات الآثار جانبية نفسها الناجمة عن إزالة جزء من الدماغ، مثل فقدان الذكريات وتراجع البصر.
يقول كريغستاين، المؤسس الشريك لشركة نيورونا الذي يعمل مستشاراً فيها: "نحن متحمسون للغاية. قد يكون هذا أول علاج خلوي للصرع". قال لي كريغستاين إنه لا يعتقد أن فترة 25 عاماً هي فترة طويلة لظهور هذا النوع من العلاجات. فهو يرد مجادلاً ويقول إن هذه الفترة "قصيرة نوعاً ما في الواقع".
يقول كريغستاين، المؤسس الشريك لشركة نيورونا الذي يعمل مستشاراً فيها: "نحن متحمسون للغاية. قد يكون هذا أول علاج خلوي للصرع".
أرنولد كريغستاين
اختبر الأطباء طعوم الخلايا العصبية من قبل؛ إذ حاولت إحدى الشركات استخدام الخلايا المستخرجة من الخنازير. لكن زميل ما بعد الدكتوراة في مختبر كريغستاين، كوري نيكولاس، هو أول من اكتشف كيف يمكن تحفيز الخلايا الجذعية الجنينية لتشكيل الخلايا العصبية البينيّة البشرية بكميات كبيرة في عام 2013.
تبع ذلك ما يصفه كريغستاين بأنه سلسلة من الخطوات "العقلانية والمنهجية" التي استغرقت عقداً من الزمن وهدفت لتحسين تلك الآلية وإجراء الاختبارات على الحيوانات ثم الحصول على الموافقة لبدء التجارب البشرية. أجرت شركة نيورونا، التي يشغل نيكولاس منصب الرئيس التنفيذي فيها، معظم هذا العمل، وجمعت أكثر من 160 مليون دولار.
يقول كريغستاين: "من الواضح أن هذا العمل لن يكون ممكناً من دون الخلايا الجذعية الجنينية [أو المستحثة]".
اقرأ أيضاً: ماذا عليك أن تفعل إذا علمت أن بعض أعضاء جسمك أكبر عمراً منك؟
لا تزال النتائج التي توصلت إليها الشركة غير مثبتة، نظراً لعلاج مريضين فقط في الدراسة التي أجرتها. ولكن هناك احتمال أن الآلية المتبعة تمثّل علاجاً حقيقياً. يعود ذلك إلى أن الخلايا المزروعة تستمر في تشكيل الروابط على الأرجح، وقد يزداد تأثيرها بمرور الوقت، ما قد يزيل النوبات تماماً. يقول كريغستاين: "بدا الأمر وكأنه حلم بعيد المنال في البداية، ولكن القدرة على تشكيل هذه الخلايا بأعداد كبيرة هي التي دفعتنا للمحاولة. والآن، تمكنا من تخفيف شدة أعراض المرضى. ستدرك أنه إنجاز مذهل بحق عندما تفكّر فيه؛ إذ إننا نكون في العيادة بعد أن زرعنا الخلايا في المرضى، وسنرى تأثير هذه الخلايا. وصلنا إلى المرحلة الحرجة التي ستوفر التجارب السريرية فيها بعض الأدلة. هل كانت النتائج وهمية، أم هي حقيقية؟"